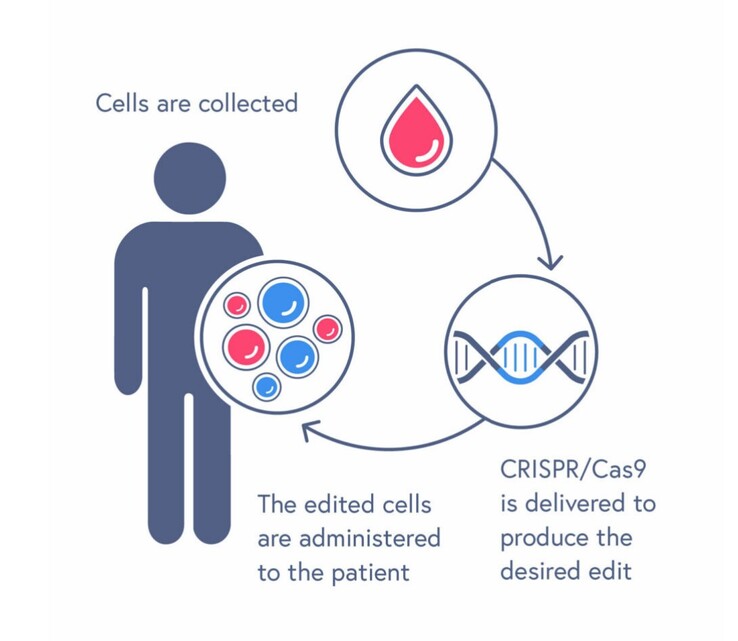
Vertex, een biotechbedrijf dat zich richt op het ontwikkelen van medische therapieën, en CRISPR Therapeutics, een bedrijf dat eigendom is van een van de ontdekkers van de CRISPR/Cas9-genbewerkingstechnologie, hebben goedkeuring gekregen van de Amerikaanse FDA voor 's werelds eerste CRISPR/Cas9-therapie CASGEVY voor de behandeling van sikkelcelziekte.
Sikkelcelziekte verlamt de getroffenen door misvormde hemoglobine in de bloedcellen, wat leidt tot bloedarmoede, problemen met de bloeddoorstroming, schade aan de milt en nog veel meer. De huidige oplossingen richten zich voornamelijk op kortetermijnsymptomen zoals acute pijn(zoals deze bij Amazon). De ziekte wordt veroorzaakt door fouten in de DNA-genen die van de ouders worden geërfd, en velen sterven voor hun 45e.
CRISPR/Cas9 werd in 2012 uitgevonden en is een met een Nobelprijs bekroonde genbewerkingstechnologie om specifieke delen van genen gemakkelijk te lokaliseren, door te knippen en te bewerken. CASGEVY gebruikt dit om fouten in de gewonnen bloedstamcellen van een patiënt te elimineren, waarna deze cellen weer in het lichaam worden ingebracht om de ziekte te genezen. CASGEVY is echter niet zonder risico's. Omdat er voor de transplantatie eerst chemotherapie moet worden gebruikt om alle slechte bloedcellen in het beenmerg te doden, komen sterfgevallen en complicaties vaak voor.
CASGEVY (exagamglogene autotemcel of exa-cel) is een eenmalige behandeling voor mensen ouder dan 12 jaar die sikkelcelziekte aanzienlijk kan verminderen of elimineren. Deze behandeling werd goedgekeurd voor gebruik in Bahrein, Engeland, Schotland en Wales in november 2023 en in Amerika in december 2023.
Top 10 Testrapporten
» Top 10 Multimedia Notebooks
» Top 10 Gaming-Notebooks
» Top 10 Budget Gaming Laptops
» Top 10 Lichtgewicht Gaming-Notebooks
» Top 10 Premium Office/Business-Notebooks
» Top 10 Budget Office/Business-Notebooks
» Top 10 Workstation-Laptops
» Top 10 Subnotebooks
» Top 10 Ultrabooks
» Top 10 Notebooks tot €300
» Top 10 Notebooks tot €500
» Top 10 Notebooks tot € 1.000De beste notebookbeeldschermen zoals getest door Notebookcheck
» De beste notebookbeeldschermen
» Top Windows Alternatieven voor de MacBook Pro 13
» Top Windows Alternatieven voor de MacBook Pro 15
» Top Windows alternatieven voor de MacBook 12 en Air
» Top 10 best verkopende notebooks op Amazon
» Top 10 Convertible Notebooks
» Top 10 Tablets
» Top 10 Tablets tot € 250
» Top 10 Smartphones
» Top 10 Phablets (>90cm²)
» Top 10 Camera Smartphones
» Top 10 Smartphones tot €500
» Top 10 best verkopende smartphones op Amazon
Bron(nen)
8 Dec 2023
Vertex en CRISPR Therapeutics kondigen goedkeuring door de Amerikaanse FDA aan van CASGEVY™ (exagamglogene autotemcel) voor de behandeling van sikkelcelziekte
- Eerste goedkeuring ooit van een op CRISPR-gebaseerde gene-editing therapie in de VS
- Ongeveer 16.000 patiënten van 12 jaar en ouder met ernstige sikkelcelziekte kunnen nu in aanmerking komen voor deze eenmalige behandeling
- Meerdere geautoriseerde behandelcentra geactiveerd
BOSTON & ZUG, Zwitserland--(BUSINESS WIRE)--Dec. 8, 2023-- Vertex Pharmaceuticals Incorporated (Nasdaq: VRTX) en CRISPR Therapeutics (Nasdaq: CRSP) hebben vandaag aangekondigd dat de U.S. Food and Drug Administration (FDA) CASGEVY™ (exagamglogene autotemcel [exa-cel]), een CRISPR/Cas9 genoom-edited celtherapie, heeft goedgekeurd voor de behandeling van sikkelcelziekte (SCD) bij patiënten van 12 jaar en ouder met terugkerende vaso-occlusieve crises (VOC's). Deze goedkeuring betekent dat voor het eerst ongeveer 16.000 patiënten met SCD in aanmerking kunnen komen voor een duurzame eenmalige therapie die het potentieel biedt voor een functionele genezing van hun ziekte door het elimineren van ernstige VOC's en ziekenhuisopnames veroorzaakt door ernstige VOC's.
"De goedkeuring van CASGEVY door de FDA is gedenkwaardig: het is de eerste op CRISPR-gebaseerde gene-editing therapie die wordt goedgekeurd in de VS. En wat nog belangrijker is, CASGEVY is een behandeling van de eerste klasse die het potentieel biedt van een eenmalige transformerende therapie voor patiënten met sikkelcelziekte die daarvoor in aanmerking komen," zei Reshma Kewalramani, M.D., Chief Executive Officer en President van Vertex. "Ik wil mijn diepste dankbaarheid overbrengen aan de patiënten en onderzoekers wier vertrouwen in dit programma de weg vrijmaakte voor deze baanbrekende goedkeuring."
"Toen ons bedrijf werd opgericht, hadden we een visie om CRISPR-technologie te vertalen naar meerdere baanbrekende therapieën. Dus deze Amerikaanse goedkeuring van het allereerste medicijn dat CRISPR gene editing gebruikt, is adembenemend en een waarlijk vernederend moment voor mij persoonlijk en voor de hele organisatie," zei Samarth Kulkarni, Ph.D., voorzitter en Chief Executive Officer van CRISPR Therapeutics.
"Het was opmerkelijk om deel uit te maken van dit baanbrekende programma," zei Stephan Grupp, M.D., Ph.D., sectiehoofd van de afdeling Cellulaire Therapie en Transplantatie en directeur van het Kelly Center for Cancer Immunotherapy in het Children's Hospital of Philadelphia, en voorzitter van de stuurgroep van het CLIMB-121 klinische programma. "CASGEVY heeft het potentieel om een transformatieve behandeling te zijn voor patiënten en ik kijk ernaar uit om verder te gaan met het werk om ervoor te zorgen dat patiënten die hiervoor in aanmerking komen toegang kunnen krijgen tot deze therapie in het hele land."
De toediening van CASGEVY vereist gespecialiseerde ervaring in stamceltransplantatie; daarom werkt Vertex samen met ervaren ziekenhuizen om een netwerk van onafhankelijk beheerde, geautoriseerde behandelcentra (ATC's) in de VS op te zetten om CASGEVY aan patiënten aan te bieden. De volgende ATC's zijn al geactiveerd:
Boston Medical Center in Boston, Mass.
Children's National Hospital in Washington, D.C.
City of Hope Children's Cancer Center in Los Angeles, Californië.
Medical City Children's Hospital in Dallas, Texas
Methodist Children's Hospital in San Antonio, Texas
Nationwide Children's Hospital in Columbus, Ohio
Het kinderziekenhuis in TriStar Centennial in Nashville, Tenn.
Het Ohio State University Comprehensive Cancer Center - James Cancer Hospital en Solove Research Institute in Columbus, Ohio
University of Chicago/Comer Children's Hospital in Chicago, Ill.
Aanvullende ATC's zullen in de komende weken worden geactiveerd en een volledige lijst van ATC's, inclusief updates na goedkeuring, is te vinden op CASGEVY.com.
Over CASGEVY™ (exagamglogene autotemcel [exa-cel])
CASGEVY is een genoom-bewerkte cellulaire therapie die bestaat uit autologe CD34+ hematopoëtische stamcellen (HSC's) die bewerkt zijn met CRISPR/Cas9-technologie in de erytroïde-specifieke enhancerregio van het BCL11A-gen. CASGEVY is bedoeld voor eenmalige toediening via een hematopoëtische stamceltransplantatieprocedure waarbij de eigen CD34+ cellen van de patiënt worden gemodificeerd om de expressie van BCL11A in erytroïde stamcellen te verminderen, wat leidt tot een verhoogde productie van foetaal hemoglobine (HbF). HbF is de vorm van zuurstofdragende hemoglobine die van nature aanwezig is tijdens de ontwikkeling van de foetus en die na de geboorte overschakelt naar de volwassen vorm van hemoglobine. CASGEVY vermindert of elimineert vaso-occlusieve crises bij patiënten met SCD.
CASGEVY werd in Groot-Brittannië door de U.K. Medicines and Healthcare products Regulatory Agency en door de National Health Regulatory Authority in Bahrein voorwaardelijk toegelaten voor patiënten van 12 jaar en ouder met SCD gekenmerkt door terugkerende vaso-occlusieve crises of transfusieafhankelijke bèta-thalassemie (TDT), voor wie hematopoëtische stamceltransplantatie geschikt is en voor wie geen hematopoëtische stamceldonor beschikbaar is die overeenkomt met een humaan leukocytenantigeen. CASGEVY wordt momenteel beoordeeld door de European Medicines Agency en de Saudi Food and Drug Agency voor zowel SCD als TDT.
Het gebruik van CASGEVY voor de behandeling van TDT in de VS blijft onderzoek. Vertex heeft een BLA ingediend bij de Amerikaanse FDA voor het mogelijke gebruik van CASGEVY voor patiënten van 12 jaar en ouder met TDT en er is een PDUFA (Prescription Drug User Fee Act) beoogde actiedatum van 30 maart 2024 aan toegekend.
Over de financiële rapportage van de Vertex/CRISPR-samenwerking
Vertex leidt de wereldwijde ontwikkeling, productie en commercialisering van CASGEVY met ondersteuning van CRISPR Therapeutics. Samen met de goedkeuring van CASGEVY door de FDA zal Vertex een mijlpaalbetaling van $200 miljoen aan CRISPR doen, die zal worden geactiveerd en afgeschreven op de verkoopkosten. Bovendien zal Vertex 100 procent van de inkomsten van CASGEVY, de verkoopkosten en de verkoop-, algemene en administratieve kosten opnemen en het aandeel van 40 procent van CRISPR in de nettowinst of het nettoverlies van CASGEVY opnemen in de verkoopkosten. Ten slotte zal Vertex 60 procent van de onderzoeks- en ontwikkelingskosten opnemen, na aftrek van CRISPR's aandeel van 40 procent.
Over sikkelcelziekte
Sikkelcelziekte (SCD) is een slopende, progressieve en levensverkortende ziekte. SCD-patiënten rapporteren scores op het gebied van levenskwaliteit die veel lager zijn dan die van de algemene bevolking, en de levenslange gezondheidszorgkosten in de VS voor het beheer van SCD voor patiënten met terugkerende VOC's worden geschat tussen $4 en $6 miljoen. SCD is een erfelijke bloedziekte die de rode bloedcellen aantast, die essentieel zijn voor het vervoeren van zuurstof naar alle organen en weefsels van het lichaam. SCD veroorzaakt ernstige pijn, schade aan organen en een verkorte levensduur als gevolg van misvormde of "verziekte" rode bloedcellen. Het klinische kenmerk van SCD zijn VOC's, die worden veroorzaakt door verstoppingen van bloedvaten door verziekte rode bloedcellen en resulteren in ernstige en slopende pijn die op elk moment overal in het lichaam kan optreden. SCD vereist een levenslange behandeling en leidt tot een verminderde levensverwachting. In de VS is de gemiddelde leeftijd waarop patiënten met SCD overlijden ongeveer 45 jaar. Een remedie voor SCD is tegenwoordig een stamceltransplantatie van een gematchte donor, maar deze optie is slechts beschikbaar voor een klein deel van de patiënten met SCD vanwege het gebrek aan beschikbare donoren.
Patiënten helpen tijdens de CASGEVY-reis
Vertex Connects™ is een programma voor in aanmerking komende patiënten in de VS die CASGEVY voorgeschreven hebben gekregen. Via Vertex Connects zijn Care Managers beschikbaar om informatie, communicatie en ondersteuning te bieden tijdens het behandeltraject, en aanvullende hulp is beschikbaar voor patiënten die hiervoor in aanmerking komen.
Voor meer informatie over ATC's, het behandeltraject van CASGEVY en Vertex Connects, bel 1-833-VERTEX-5 (1-833-837-8395) - en kom meer te weten over ons ondersteuningsprogramma voor patiënten op VertexConnects.com.
V.S. INDICATIES EN BELANGRIJKE VEILIGHEIDSINFORMATIE VOOR CASGEVY (exagamglogene autotemcel)
CASGEVY is een eenmalige therapie die wordt gebruikt voor de behandeling van mensen van 12 jaar en ouder met sikkelcelziekte (SCD) die vaak vaso-occlusieve crises of VOC's hebben.
CASGEVY wordt specifiek voor elke patiënt gemaakt, met behulp van de eigen bewerkte bloedstamcellen van de patiënt, en verhoogt de productie van een speciaal type hemoglobine dat hemoglobine F (foetaal hemoglobine of HbF) wordt genoemd. Het hebben van meer HbF verhoogt het algehele hemoglobinegehalte en er is aangetoond dat het de productie en functie van rode bloedcellen verbetert. Dit kan VOC's bij mensen met SCD elimineren.
BELANGRIJKE VEILIGHEIDSINFORMATIE
Wat is de belangrijkste informatie die ik moet weten over CASGEVY?
Na de behandeling met CASGEVY zult u een tijdje minder bloedcellen hebben totdat CASGEVY zich in uw beenmerg vastzet (engraft). Dit omvat lage niveaus van bloedplaatjes (cellen die gewoonlijk het bloed helpen stollen) en witte bloedcellen (cellen die gewoonlijk infecties bestrijden). Uw arts zal dit in de gaten houden en u zo nodig een behandeling geven. De arts zal u vertellen wanneer de bloedcelwaarden weer op een veilig niveau komen.
Vertel het uw arts onmiddellijk als u last krijgt van een van de volgende verschijnselen, die tekenen kunnen zijn van lage bloedplaatjescellenwaarden:
ernstige hoofdpijn
abnormale blauwe plekken
langdurig bloeden
bloeden zonder verwonding zoals neusbloedingen; bloeden van het tandvlees; bloed in uw urine, ontlasting of braaksel; of het ophoesten van bloed
Vertel het uw zorgverlener meteen als u een van de volgende dingen ervaart, die tekenen kunnen zijn van een laag gehalte aan witte bloedcellen:
koorts
rillingen
infecties
U kunt bijwerkingen ondervinden van andere geneesmiddelen die worden toegediend als onderdeel van de behandelingskuur met CASGEVY. Praat met uw arts over deze mogelijke bijwerkingen. Uw arts kan u andere geneesmiddelen geven om uw bijwerkingen te behandelen.
Hoe krijg ik CASGEVY?
Uw zorgverlener zal u andere geneesmiddelen geven, inclusief een conditionerend geneesmiddel, als onderdeel van uw behandeling met CASGEVY. Het is belangrijk om met uw zorgverlener te praten over de risico's en voordelen van alle medicijnen die bij uw behandeling betrokken zijn.
Nadat u het conditionerende geneesmiddel heeft gekregen, is het misschien niet mogelijk voor u om zwanger te worden of een kind te verwekken. U moet de opties voor vruchtbaarheidsbehoud vóór de behandeling met uw zorgverlener bespreken.
STAP 1: Vóór de CASGEVY-behandeling zal een arts u een mobilisatiemedicijn geven. Dit medicijn verplaatst bloedstamcellen van uw beenmerg naar de bloedstroom. De bloedstamcellen worden vervolgens verzameld in een machine die de verschillende bloedcellen scheidt (dit wordt aferese genoemd). Dit hele proces kan meerdere keren plaatsvinden. Elke keer kan het tot een week duren.
Tijdens deze stap worden ook reddingscellen verzameld en opgeslagen in het ziekenhuis. Dit zijn uw bestaande bloedstamcellen en worden onbehandeld bewaard voor het geval er een probleem optreedt tijdens het behandelingsproces. Als CASGEVY niet gegeven kan worden na de conditionerende medicijnen, of als de gemodificeerde bloedstamcellen niet aanslaan (engraft) in het lichaam, zullen deze reddingscellen aan u teruggegeven worden. Als u reddingscellen krijgt, heeft u geen voordeel van CASGEVY.
STAP 2: Nadat ze verzameld zijn, worden uw bloedstamcellen naar de productielocatie gestuurd waar ze gebruikt worden om CASGEVY te maken. Het kan tot 6 maanden duren vanaf het moment dat uw cellen zijn verzameld om CASGEVY te produceren en te testen voordat het naar uw zorgverlener wordt teruggestuurd.
STAP 3: Kort voor uw stamceltransplantatie zal uw zorgverlener u een paar dagen in het ziekenhuis een conditionerend medicijn geven. Dit zal u voorbereiden op de behandeling door cellen uit het beenmerg te verwijderen, zodat ze vervangen kunnen worden door de gemodificeerde cellen in CASGEVY. Nadat u dit medicijn heeft gekregen, zullen uw bloedcelwaarden dalen tot zeer lage niveaus. U blijft in het ziekenhuis voor deze stap en blijft in het ziekenhuis tot na de infusie met CASGEVY.
STAP 4: Eén of meer injectieflacons CASGEVY zullen in een korte periode in een ader worden toegediend (intraveneuze infusie).
Na de CASGEVY infusie blijft u in het ziekenhuis zodat uw zorgverlener uw herstel nauwlettend kan volgen. Dit kan 4-6 weken duren, maar dit kan variëren. Uw zorgverlener zal beslissen wanneer u naar huis mag.
Wat moet ik vermijden nadat ik CASGEVY heb gekregen?
Doneer in de toekomst geen bloed, organen, weefsels of cellen
Wat zijn de mogelijke of redelijk waarschijnlijke bijwerkingen van CASGEVY?
De meest voorkomende bijwerkingen van CASGEVY zijn:
Lage niveaus van bloedplaatjescellen, die het vermogen van bloed om te stollen kunnen verminderen en bloedingen kunnen veroorzaken
Lage niveaus van witte bloedcellen, wat u vatbaarder kan maken voor infecties
Uw zorgverlener zal uw bloed testen om te controleren op lage concentraties bloedcellen (waaronder bloedplaatjes en witte bloedcellen). Vertel het uw zorgverlener meteen als u een van de volgende symptomen krijgt:
koorts
rillingen
infecties
ernstige hoofdpijn
abnormale blauwe plekken
langdurig bloeden
bloeden zonder verwonding zoals neusbloedingen; bloeden uit het tandvlees; bloed in uw urine, ontlasting of braaksel; of het ophoesten van bloed
Dit zijn niet alle mogelijke bijwerkingen van CASGEVY. Bel uw arts voor medisch advies over bijwerkingen. U kunt bijwerkingen melden aan de FDA op 1-800-FDA-1088.
Algemene informatie over veilig en effectief gebruik van CASGEVY
Praat met uw zorgverlener over eventuele gezondheidsproblemen.
Raadpleeg de volledige voorschrijfinformatie inclusief patiënteninformatie voor CASGEVY.
Over Vertex
Vertex is een wereldwijd biotechnologiebedrijf dat investeert in wetenschappelijke innovatie om transformatieve geneesmiddelen te creëren voor mensen met ernstige ziekten. Het bedrijf heeft geneesmiddelen goedgekeurd die de onderliggende oorzaken van meerdere chronische, levensverkortende genetische ziekten behandelen - taaislijmziekte, sikkelcelziekte en transfusieafhankelijke bèta-thalassemie - en blijft klinische en onderzoeksprogramma's voor deze ziekten ontwikkelen. Vertex heeft ook een robuuste klinische pijplijn met onderzoekstherapieën voor verschillende modaliteiten voor andere ernstige ziekten waarbij het diepgaand inzicht heeft in de causale menselijke biologie, waaronder APOL1-gemedieerde nieraandoeningen, acute en neuropathische pijn, type 1-diabetes en alfa-1-antitrypsinedeficiëntie.
Vertex werd opgericht in 1989 en heeft zijn wereldwijde hoofdkantoor in Boston, met een internationaal hoofdkantoor in Londen. Daarnaast heeft het bedrijf onderzoeks- en ontwikkelingslocaties en commerciële kantoren in Noord-Amerika, Europa, Australië en Latijns-Amerika. Vertex wordt voortdurend erkend als een van de beste werkgevers in de sector, waaronder 14 opeenvolgende jaren op de lijst van Top Employers van Science magazine en een van de 100 Best Companies to Work For van Fortune. Ga voor bedrijfsupdates en meer informatie over de innovatiegeschiedenis van Vertex naar www.vrtx.com of volg ons op LinkedIn, Facebook, Instagram, YouTube en Twitter/X.
Over CRISPR Therapeutics
CRISPR Therapeutics is een toonaangevend gen-editing bedrijf dat zich richt op het ontwikkelen van transformatieve gen-gebaseerde geneesmiddelen voor ernstige ziekten met behulp van het gepatenteerde CRISPR/Cas9 platform. CRISPR/Cas9 is een revolutionaire genbewerkingstechnologie die nauwkeurige, gerichte veranderingen in genomisch DNA mogelijk maakt. CRISPR Therapeutics heeft een portefeuille opgebouwd van therapeutische programma's voor een groot aantal ziekten, waaronder hemoglobinopathieën, oncologie, regeneratieve geneeskunde en zeldzame ziekten. Om zijn inspanningen te versnellen en uit te breiden, heeft CRISPR Therapeutics strategische samenwerkingen opgezet met toonaangevende bedrijven, waaronder Bayer, Vertex Pharmaceuticals en ViaCyte, Inc. CRISPR Therapeutics AG heeft zijn hoofdkantoor in Zug, Zwitserland, met zijn Amerikaanse dochteronderneming CRISPR Therapeutics, Inc., en R&D-activiteiten in Boston, Massachusetts en San Francisco, Californië, en kantoren in Londen, Verenigd Koninkrijk. Ga voor meer informatie naar www.crisprtx.com.
CRISPR THERAPEUTICS® woordmerk en ontwerp zijn handelsmerken en gedeponeerde handelsmerken van CRISPR Therapeutics AG. Alle andere handelsmerken en gedeponeerde handelsmerken zijn het eigendom van hun respectieve eigenaars.
Speciale opmerking van Vertex met betrekking tot toekomstgerichte verklaringen
Dit persbericht bevat toekomstgerichte verklaringen zoals gedefinieerd in de Private Securities Litigation Reform Act van 1995, zoals gewijzigd, inclusief, zonder beperking, de verklaringen van Reshma Kewalramani, M.D., Samarth Kulkarni, Ph.D., en Stephan Grupp, M.D., Ph.D., en verklaringen betreffende de verwachte patiëntenpopulatie die in aanmerking komt voor CASGEVY in de VS, verwachtingen voor de potentiële voordelen van CASGEVY, verwachtingen dat bijkomende ATC's in de komende weken zullen worden geactiveerd, Vertex's plan om mijlpaalbetalingen aan CRISPR te doen, en Vertex's verwachte boekhoudkundige behandeling voor mijlpaalbetalingen, verwachte inkomsten, verkoopkosten, uitgaven en nettowinst of -verlies in verband met CASGEVY. Hoewel Vertex van mening is dat de toekomstgerichte verklaringen in dit persbericht accuraat zijn, geven deze toekomstgerichte verklaringen alleen de overtuigingen van het bedrijf weer op de datum van dit persbericht en zijn er een aantal risico's en onzekerheden die ertoe kunnen leiden dat werkelijke gebeurtenissen of resultaten wezenlijk verschillen van die uitgedrukt of geïmpliceerd door dergelijke toekomstgerichte verklaringen. Deze risico's en onzekerheden omvatten, onder andere, dat gegevens uit de ontwikkelingsprogramma's van het bedrijf mogelijk de registratie of verdere ontwikkeling van de samenstellingen niet ondersteunen vanwege de veiligheid, werkzaamheid of andere redenen, dat het verkrijgen van goedkeuring voor en de commercialisering van CASGEVY in Europa en het Koninkrijk Saoedi-Arabië mogelijk niet op de verwachte tijdlijn plaatsvindt, of helemaal niet, en andere risico's die vermeld staan onder het kopje "Risicofactoren" in Vertex's meest recente jaarverslag en daaropvolgende deponeringen bij de Securities and Exchange Commission op www.sec.gov en beschikbaar zijn via de website van het bedrijf op www.vrtx.com. U moet niet overmatig vertrouwen op deze verklaringen of de gepresenteerde wetenschappelijke gegevens. Vertex wijst elke verplichting af om de informatie in dit persbericht bij te werken wanneer nieuwe informatie beschikbaar wordt.
CRISPR Therapeutics Toekomstgerichte verklaring
Dit persbericht kan een aantal "toekomstgerichte verklaringen" bevatten in de zin van de Private Securities Litigation Reform Act van 1995, zoals gewijzigd, waaronder verklaringen van Reshma Kewalramani, M.D., Samarth Kulkarni, Ph.D., en Stephan Grupp, M.D., Ph.D., in dit persbericht, evenals verklaringen met betrekking tot CRISPR Therapeutics': (i) plannen en verwachtingen voor de commercialisering van, en verwachte voordelen van, CASGEVY, met inbegrip van de verwachte patiëntenpopulatie die in aanmerking komt voor CASGEVY in de Verenigde Staten en de toegang van patiënten tot CASGEVY; (ii) verwachtingen met betrekking tot de lopende klinische studies met exa-cel, met inbegrip van mogelijke implicaties van klinische gegevens voor patiënten; (iii) tijdlijnen voor en verwachtingen met betrekking tot bijkomende beslissingen van regelgevende instanties; (iv) ontvangst van de mijlpaalbetaling van Vertex; en (v) verwachtingen met betrekking tot de therapeutische waarde, ontwikkeling en het commerciële potentieel van CRISPR/Cas9 gene editing technologieën en therapieën. Zonder het voorgaande te beperken, zijn de woorden "gelooft", "anticipeert", "plant", "verwacht" en soortgelijke uitdrukkingen bedoeld om toekomstgerichte verklaringen aan te duiden. U wordt gewaarschuwd dat toekomstgerichte verklaringen inherent onzeker zijn. Hoewel CRISPR Therapeutics van mening is dat dergelijke verklaringen gebaseerd zijn op redelijke veronderstellingen binnen de grenzen van zijn kennis van zijn activiteiten en operaties, worden bestaande en toekomstige beleggers gewaarschuwd dat toekomstgerichte verklaringen inherent onzeker zijn, geen beloften of garanties zijn en dat ze niet overmatig moeten worden vertrouwd op dergelijke verklaringen, die alleen gelden op de datum waarop ze worden gedaan. De werkelijke prestaties en resultaten kunnen wezenlijk verschillen van die welke in de toekomstgerichte verklaringen worden voorspeld of gesuggereerd als gevolg van verschillende risico's en onzekerheden. Deze risico's en onzekerheden omvatten, onder andere, dat: de klinische gegevens van lopende klinische studies van exa-cel niet zullen worden voortgezet of herhaald in lopende of geplande klinische studies of mogelijk geen reglementaire goedkeuring of hernieuwing van voorwaardelijke toelating ondersteunen; reglementaire goedkeuring in andere rechtsgebieden mogelijk niet op de verwachte tijdstippen of helemaal niet plaatsvindt; mogelijk geen adequate prijsstelling of terugbetaling kan worden verzekerd om de verdere ontwikkeling of commercialisering van exa-cel na reglementaire goedkeuring te ondersteunen; toekomstige concurrerende of andere marktfactoren het commerciële potentieel voor CASGEVY negatief kunnen beïnvloeden; CRISPR Therapeutics realiseert mogelijk niet de potentiële voordelen van zijn samenwerking met Vertex; er zijn onzekerheden met betrekking tot de bescherming van de intellectuele eigendom voor de technologie van CRISPR Therapeutics en de intellectuele eigendom die toebehoort aan derden; en de risico's en onzekerheden die worden beschreven onder de rubriek "Risicofactoren" in het meest recente jaarverslag op formulier 10-K, kwartaalverslag op formulier 10-Q, en in andere latere deponeringen door CRISPR Therapeutics bij de Amerikaanse Securities and Exchange Commission.S. Securities and Exchange Commission, die beschikbaar zijn op de website van de SEC op www.sec.gov. CRISPR Therapeutics wijst elke verplichting of verbintenis af om toekomstgerichte verklaringen in dit persbericht bij te werken of te herzien, behalve voor zover wettelijk vereist.
Bekijk de bronversie op businesswire.com: www.businesswire.com/news/home/20231208951733/en/
Vertex Pharmaceuticals Incorporated
Investeerders:
of
Manisha Pai, +1 617-961-1899
Media:
of
Internationaal: +44 20 3204 5275
of
V.S.: 617-341-6992
of
Heather Nichols: +1 617-839-3607
CRISPR-therapeutica
Investeerders:
Susan Kim, +1 617-307-7503
Media:
Rachel Eides, +1 617-315-4493
Bron: Vertex Pharmaceuticals Incorporated